Clasificación de los materiales metálicos:
Los materiales metálicos se pueden dividir en dos grandes grupos: férreos y no férreos.
Dentro de los materiales férreos encontramos el hierro y sus aleaciones, que básicamente son acero y fundición.
HIERRO
El hierro es el metal duro más usado, con el 95% en peso de la producción mundial de metal. El hierro puro (pureza a partir de 99,5%) no tiene demasiadas aplicaciones, salvo excepciones para utilizar su potencial magnético. El hierro tiene su gran aplicación para formar los productos siderúrgicos, utilizando éste como elemento matriz para alojar otros elementos aleantes tanto metálicos como no metálicos, que confieren distintas propiedades al material. Se considera que una aleación de hierro es acero si contiene menos de un 2,1% de carbono; si el porcentaje es mayor, recibe el nombre de fundición.
ACERO Y FUNDICIÓN
El acero es una aleación de hierro con una cantidad de carbono
variable entre el 0,03% y el 1,075% en peso de su composición,
dependiendo del grado. Si la aleación posee una concentración de carbono
mayor al 2,0% se producen fundiciones que, en oposición al acero, son mucho más frágiles y no es posible forjarlas sino que deben ser moldeadas.
Las fundiciones son aleaciones hierro-carbono
donde el contenido de carbono varía entre 2,14% y 6,67% (aunque estos
porcentajes no son completamente rígidos). Comúnmente las más usadas
están entre los valores de 2,5% y 4,5%, ya que las de mayor contenido de
carbono carecen de valor práctico en la industria. Además de hierro y
carbono, lleva otros elementos de aleación como silicio, manganeso, fósforo, azufre y oxígeno.
Los principales tipos de fundición son blanca y gris.
Fundición blanca:
- El carbono aparece en forma de cementita.
- La cantitad de silicio es mínima.
- Las velocidades rápidas de enfriamiento favorece la formación de la cementita.
- Tienen una alta resistencia mecánica y dureza, pero también gran fragilidad (propiedades debidas a la cementita), por lo que son difíciles de mecanizar.
- Presentan el carbono en forma de grafito laminar.
- Suelen estar aleados con silicio (elemento muy grafitizante).
- Una lenta velocidad de enfriamiento favorece la formación de una fundición gris ya que la lentitud en las reacciones favorece que se formen los constituyentes más estables: la cementita se transforma en ferrita y grafito (grafitización). Son fácilmente mecanizables ya que el grafito favorece la salida de la viruta.
METALES NO FÉRREOS
- Pesados
- Estaño (Sn):
- Cobre:
- Cobalto (Co)
- Ligeros
- Titanio:
-Punto de fusión: 1800 °C.
-Resistividad: 0,8 W•mm2/m.
-Resistencia a la tracción: 100Kg/mm2
-Alargamiento: 5%
- Aluminio:
- Ultraligeros
- Magnesio (Mg):
Enlace metálico
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de líneas tridimensionales que adquieren estructuras tales como: la típica de empaquetamiento compacto de esferas (hexagonal compacta), cúbica centrada en las caras o la cúbica centrada en el cuerpo.
En este tipo de estructura cada átomo metálico está dividido por otros doce átomos (seis en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja electronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales. Este enlace sólo puede estar en sustancias en estado sólido.
Los metales poseen algunas propiedades características que los diferencian de los demás materiales. Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y tienen un punto de fusión alto.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica. Los metales generalmente presentan brillo y son maleables. Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes. Muchos de los metales tienen puntos de fusión más altos que otros elementos no metálicos, por lo que se puede inferir que hay enlaces más fuertes entre los distintos átomos que los componen. La vinculación metálica es no polar, apenas hay diferencia de electronegatividad entre los átomos que participan en la interacción de la vinculación (en los metales, elementales puros) o muy poca (en las aleaciones), y los electrones implicados en lo que constituye la interacción a través de la estructura cristalina del metal. El enlace metálico explica muchas características físicas de metales, tales como maleabilidad, ductilidad, buenos en la conducción de calor y electricidad, y con brillo o lustre (devuelven la mayor parte de la energía lumínica que reciben).
La vinculación metálica es la atracción electrostática entre los átomos del metal o cationes y los electrones deslocalizados. Esta es la razón por la cual se puede explicar un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad.
Los átomos del metal tienen por lo menos un electrón de valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones. En lugar los niveles de energía externos de los átomos del metal se traslapan. Son como enlaces covalentes identificados.
Propiedades físicas y químicas de los metales
Los metales muestran un amplio margen en sus propiedades físicas. La mayoría de ellos son de color grisáceo, pero algunos presentan colores distintos; el bismuto (Bi) es rosáceo, el cobre (Cu) rojizo y el oro (Au) amarillo. En otros metales aparece más de un color, y este fenómeno se denomina pleocroismo.
Otras propiedades serían:
- densidad: relación entre la masa del volumen de un cuerpo y la masa del mismo volumen de agua.
- estado físico: todos son sólidos a temperatura ambiente, excepto el Hg.
- brillo: reflejan la luz.
- maleabilidad: capacidad de lo metales de hacerse láminas.
- ductilidad: propiedad de los metales de moldearse en alambre e hilos.
- tenacidad: resistencia que presentan los metales a romperse por tracción.
- conductividad: son buenos conductores de electricidad y calor.
La más baja conductividad eléctrica la tiene el bismuto, y la más alta a temperatura ordinaria la plata. La conductividad en los metales puede reducirse mediante aleaciones. Todos los metales se expanden con el calor y se contraen al enfriarse.
Los materiales como el oro, la plata o el cobre tienen conductividades térmicas elevadas y conducen bien el calor. Se piensa que el libre movimiento de los electrones es la causa de su alta conductividad eléctrica y térmica. La principal objeción a esta teoría es que en tal caso los metales deben tener un calor específico superior al que realmente tienen.
Atomicidad
Es el no. total de átomos que intervienen en una molécula, sin importar si son iguales o diferentes. Por su atomicidad las moléculas se clasifican en monoatómicas, diatómicas, triatómicas, tetratómicas y poliatómicas. En los metales sus moléculas únicamente son monoatómicas.
Todo átomo de metal tiene únicamente un no. limitado de electrones de valencia con los que se unirá a los átomos vecinos. Por ello se requiere un amplio reparto de electrones entre los átomos individuales. El reparto de electrones se consigue por la superposición de orbitales atómicos de energía equivalente con los átomos adyacentes.
Comportamiento Iónico
Por tener valores bajos de potencial de ionización, su tendencia es perder electrones para formar iones positivos o cationes. Por esta razón los átomos de los metales son electropositivos y se combinan fácilmente con los átomos electronegativos de los no metales.
Potencial de Oxidación
Es la tendencia de una sustancia a ser oxidada. Se mide en la pila de Daniels y se expresa en voltios (V). E0 = E01 + E02
La oxidación de un cuerpo corresponde a la pérdida de electrones y la reducción corresponde a una ganancia de electrones. Algunos elementos como el cobre y el mercurio reaccionan lentamente para formar los óxidos, incluso cuando se les calienta. Los metales inertes, como el platino, el iridio y el oro únicamente forman óxidos por métodos indirectos.
Formación de Hidruros
Los metales forman hidruros al unirse con el hidrógeno (H). Sólo en esta función el hidrógeno trabaja con la valencia –1, ya que los metales de los grupos IA y IIA tienen valores de electronegatividad menor que él.
Para nombrarlos se escribe primero la palabra "Hidruro" y después el nombre del metal.
- NaH - Hidruro de Sodio
- KH - Hidruro de Potasio
Compuestos binarios formados por un metal y oxígeno. Estos compuestos siempre son neutrales. Hay dos formas para nombrarlos.
Ginebra: Se escribe la palabra "Óxido" seguida por el metal con la terminación "-ico" si está utilizando su mayor valencia u "-oso" si utiliza la menor.
U.I.Q.P.A.: Si escriben las palabras "Óxido de –" seguidas del metal indicando con no. romano la valencia que usa.
En ambas formas si el metal tiene valencia única, sólo se escribirán las palabras "Óxido de –" y el metal.
Reacción con Ácidos
Cuando un metal tiene potencial de oxidación positiva (E0+) libera hidrógeno (H2) al reaccionar con los ácidos.
Fe + 2HCl FeCl2 + H2 Reacción con el Agua
Únicamente los metales con potencial de oxidación igual o mayor de +0.83 V reaccionan con el agua (H2O) liberando H2.
2Na + H2O Na2O + H2 Zn + H20 no hay reacción Desplazamiento por Metales Activos. Galvanizado.
Metales con potencial de oxidación alto , desplazan a los metales de menor potencial de sus sales en solución en procesos electrolíticos.
Galvanizado: recubrimiento de hierro o acero con una capa de cinc como protección a la corrosión. Zn + CuSO4 cc ZnSO4 + Cu Metales Anfóteros
Este tipo de metales, como el Al, Pb, Zn, etc. liberan hidrógeno de las soluciones alcalinas formando iones complejos. Zn +2OH-1 +2HOH H2 +Zn(OH)4-2 Estructura interna de los metales
Se le llama estructura de los metales a la disposición ordenada y geométrica, en el espacio, de los constituyentes de la materia en estado sólido (átomos, moléculas y grupos de moléculas). La estructura está ligada íntimamente con el comportamiento de un metal, por lo que es conveniente efectuar un estudio elemental de la misma.
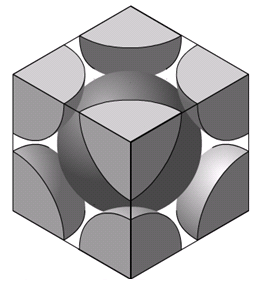
Estructura Cristalina: En esta estrucutura, los átomos estánordenados en el espacio según una red geométrica constituída por la repetición de un elemento básico llamado cristal. Se conocen catorce redes espaciales distintas las cuales son las únicas formas posibles de ordenar los átomos en el espacio. La mayor parte de los metales cristalizan en las redes siguientes: cúbica centrada en el cuerpo, cúbica centrada en las caras y hexagonal compacta.
Estructura
cúbica centrada en el cuerpo
Formada
por un átomo del metal en cada uno de los vértices de
un cubo y un átomo en el centro. Cada átomo de la estructura, está rodeado por ocho átomos
adyacentes y los átomos de los vértices están en
contacto según las diagonales del cubo. Los metales que cristalizan
en esta estructura son: hierro alfa, titanio, tungsteno, molibdeno,
niobio, vanadio, cromo, circonio, talio, sodio y potasio.
Estructura cúbica centrada en las caras
Está
constituida por un átomo en cada vértice y un átomo
en cada cara del cubo.
Cada átomo está rodeado por doce átomos adyacentes
y los átomos de las caras están en contacto. Los metales que cristalizan en esta estructura
son: hierro gama, cobre, plata, platino, oro, plomo y níquel.
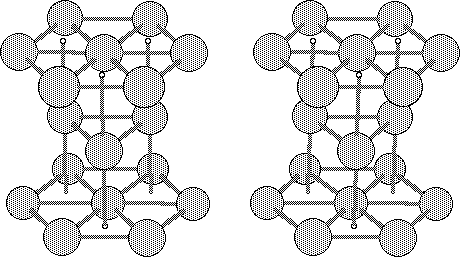
Estructura hexagonal compacta
Esta estructura está determinada por un átomo en cada uno de los vértices de un prisma hexagonal, un átomo en las bases del prisma y tres átomos dentro de la celda unitaria.
Cada átomo está rodeado por doce átomos y estos están en contacto según los lados de los hexágonos bases del prisma hexagonal. Algunos metales sufren cambio de estructura a diferentes temperaturas como el hierro que se presenta como cúbico centrado a temperatura normal pero cambia a centrado en las caras a 912°C y vuelve a ser cúbico centrado a 1400°C; cuando un metal cambia su estructura de esta manera se dice que es alotrópico. Los metales que cristalizan en esta forma de estructura son: titanio, magnesio, cinc, berilio, cobalto, circonio y cadmio.
La humanidad y los metales
Su fecha de aparición, duración y contexto varía dependiendo de la región estudiad. El periodo de la evolución tecnológica de la humanidad caracterizado por el desarrollo de la metalurgia;comienza antes del V milenio a. C. y acabaría en cada lugar con la entrada en la Historia, para buena parte de Europa en el I milenio a. C. El uso de los metales nace en la Península de Anatolia a partir del 5.000 a.C.
De allí se difunde a Mesopotamia y Egipto: carecen de yacimientos minerales y se inicia un comercio de metales a través del Mediterráneo, en busca de cobre y estaño. Este contacto permite la difusión de su conocimiento y permite el desarrollo cultural de los pueblos que comerciarán con los orientales. El hombre nesecitó de elementos fuertes y resistentes que e permitiernan una mejor confeccion de sus utensilios y armas ; ello lo encontró al emplear los metales desde, aproximadamente ,el año 4 000 a.c .
Este nuevo momento en el discurrir de la humnanidad toma, por ello,el nombre de edad de los metales que se divide en : Edad de Cobre , Edad de Bronce y Edad de Hierro.
Edad de cobre o calcolitico ( 4000 -3000 a.c )
-El hombre prehistórico aprendió a usar el cobre, el cual era facil de obtener debido a sus presencia en la superficie terrestre mezclado con otros minerales (el hombre aprende el proceso de la metalurgia, a través de la experimentación o de la casualidad ,caída de cobre al fuego ).Asi construyó vasijas y arma cuyo uso combinaron con la piedra pulimentada.Caracteristicas:
-Invencion de la metalurgia
-Desarrollo de la agricultura: arado,regadio,estiercol y nuevos cultivos (olivo ,vid...)
-Desarrollo de laganaderia, domesticación del asno y el buey, obtención de leche ,lana ,queso, yogurt...
-Desarrollo de la minería
El cobre, junto con el oro y la plata, es de los primeros metales utilizados en la Prehistoria
Edad de Bronce ( 3 000 - 1 500 a.c )
-El bronces es resultado de la aleacion de cobre (90%) + estaño (10%) aproximadamente , obteniendose un metal mas duro y resistente
-Aparición del primer Estado, la primera autoridad política.
-La organización social se ha hecho más compleja que en los poblados neolíticos. Desaparición de la igualdad social
-Surge en el Creciente Fértil hacia el IV milenio a. C
-El bronce se origina en la actual Armenia, en torno al año 2800 a.C., pero tambien simultáneamente en la India, Irán, Sumeria y Egipto. Hacia el 2400 a.C. llega al Egeo y hacia el 1700 a.C. a Europa.
-En Europa central se introdujo hacia el año 1800-1600 y se desarrolla hasta el 700 a.C. En este periodo se generalizan las construcciones megalíticas.
-El mar Egeo es un área de intenso comercio del bronce.
Edad de Hierro (1 500 a.c )
-Es el estadio en el desarrollo de una civilización en el que se descubre y populariza el uso del hierro como material para fabricar armas y herramientas.
- En algunas sociedades antiguas, las tecnologías metalúrgicas necesarias para poder trabajar el hierro aparecieron de forma simultánea a otros cambios tecnológicos y culturales, incluyendo muchas veces cambios en la agricultura, las creencias religiosas y los estilos artísticos, aunque ese no ha sido siempre el caso.
-El hierro le permitio al hombre dominarmejor elmedio y ampliar su horizonte cultural.Los hititas fueron los primeros en usar el hierro
-Los primeros en trabajar el hierro en abundancia fueron los hititas, hacia el 1300 a.C., que lo exportaban a Egipto y a Asiria. En Grecia el hierro entró con los dorios hacia el 1200 a.C. En el resto de Europa alcanzó su máximo esplendor hacia el 450 a.C., con la cultura de La Tène.
-El hierro era un metal mucho más duro y duradero que el bronce, pero también necesita unas temperaturas mucho mayores para su fundición
Supone un cambio tecnológico consistente en la generalización de la metalurgia para construir los utensilios de trabajo.
La edad de los metales convive con los primeros pasos de la historia: así mientras en Mesopotamia y el Creciente Fértil ya había manifestaciones escritas a Europa occidental estaban llegando las innovaciones neolíticas de la metalurgia: no debe olvidarse que la humanidad no ha pasado de una edad a otra en la misma época en todos los lugares, pues sus progresos no han seguido los mismos pasos en todas partes.
Extracción, producción y reciclado de materiales metálicos.
Los metales no ferrosos provienen de minerales que se pueden encontrar en la superficie de la tierra o bien en yacimientos bajo la superficie. En ambos casos se deben seguir técnicas de explotación eficientes y rentables.
Refinado o concentrado, también conocido como preparación.
Los minerales de los que se obtienen los metales no ferrosos nunca se encuentra en estado puro y en cantidades comerciales, por lo que se deben separar y preparar. Entre los procesos de preparación más utilizados está el pulverizar al mineral y luego mezclarlo con agua y un aceite, para que al aplicar una acción violenta se forme espuma en la que los elementos metálicos quedan suspendidos. Posteriormente se retira la espuma y con ella los minerales necesarios para la producción de los metales no ferrosos.
Fusión.
Los hornos más utilizados para la fusión de los minerales de metales no ferrosos son los altos hornos (de menor tamaño que los de arrabio) y los hornos de reverbero (aquellos en los que la flama ilumina a la carga). Aunque no todos los metales no ferrosos necesitan ser fundidos primero para ser procesados.
En los hornos para la producción de los metales no ferrosos siempre existen equipos para el control de las emisiones de polvo. Más que una medida de control de la contaminación ambiental es una necesidad, ya que los polvos son valiosos porque tienen el mineral que se está procesando o porque de esos polvos se pueden obtener otros materiales con un valor representativo o rentable.
Afinado.
Para lograr las características de calidad y pureza necesarias en los metales no ferrosos se pueden utilizar diferentes procesos como las tinas electrolíticas con las que el mineral adquiere niveles de calidad muy altos.
La mayor parte de los metales que existen pueden fundirse y volver a procesare creando nuevos metales. Metales como aluminio, plomo, hierro, acero, cobre, plata y oro son reciclados fácilmente cuando no están mezclados con otras sustancias, porque pueden ser fundidos y cambiar de forma o adoptar la misma anterior. De estos materiales, el hierro es el que tiene mayor demande comercial. El reciclaje del aluminio esta incrementándose bastante debido a que una lata, producto de reciclaje, requiere solo una parte de la energía necesaria para elaborar una lata similar con materas primas. Si recuperáramos todos estos metales serian una gran fuente de materias primas.
Los yacimientos (de donde se extraen industrialmente el metal), son depósitos de los mismos y están siendo poco a poco agotados. En los nuevos yacimientos se debe invertir mayor capital, ya que se encuentran mas adentrados en la corteza terrestre y en lugares muy remotos para el centro de producción. El cobre, desde los 80, procede de lugares como chile, Zambia, Zaire, Papúa, Nueva-Guinea, lugares muy lejanos del centro de producción. En 1990, para obtener los, casi, 9 millones de toneladas de cobre que se produjeron hizo falta extraer y reprocesar 990 toneladas de mineral.
Proceso de reciclado:
- Latas de conservas
- Latas de cerveza
- Tapas de metal
- Botones de metal
- Papel aluminio
- Bolsa interior de la leche en polvo
- Alfileres
- Alambre
- Cacerola de aluminio
- Etc.
En 1990, mas del 50% de las latas de aluminio fabricadas en EE.UU. fueron producto del reciclaje. En la actualidad se recicla todo el aluminio que se produce como recorte durante la fabricación de productos y una parte importante del resto.
Los expertos aseguran que se sala suficiente energía reciclando una lata de aluminio como para hacer funcionar un televisor durante 3 horas y media, además reduce la contaminación en un 95%.
El reciclado de aluminio sé esta poniendo de moda ya que todos queremos reciclar aunque a algunos le importe mas la ganancia económica que la contaminación que producen estos desechos.
El aluminio no cambia sus características durante el reciclado por lo que se puede repetir indefinidamente, además los botes se pueden hacer enteramente con metal reciclado.
Hay muchos modos de reciclar botes. En algunos países el reciclado viene impuesto por la legislación y se gestiona a través de consorcios. En otros países el reciclado es voluntario. Esta actividad la organiza organizaciones voluntarias, proyectos escolares, el ayuntamiento, etc.
Oxidación y corrosión
Los materiales están expuestos continuamente a los más diversos ambientes de interacción material-ambiente provoca, en muchos casos, la pérdida o deterioro de las propiedades físicas del material. Los mecanismos de deterioro son diferentes según se trate de materiales metálicos, cerámicos o polímeros (plásticos). Así, en el hierro, en presencia de la humedad y del aire, se transforma en óxido, y si el ataque continúa acaba destruyéndose del todo. Desde el punto de vista económico, la corrosión ocasiona pérdidas muy elevadas.
En los materiales metálicos, el proceso de deterioro se llama oxidación y corrosión. Por otro lado, en los
cerámicos las condiciones para el deterioro han de ser extremas, y hablaremos también de corrosión. Sin embargo, la pérdida de las propiedades de los materiales polímeros se denomina degradación. En el deteriores de materiales podemos distinguir dos procesos:
1.Oxidación directa
Resulta de la combinación de los átomos metálicos con los de la sustancia agresiva.
2.Corrosión electroquímica o corrosión en líquidos.
En este caso, el metal es atacado por un agente corrosivo en presencia de un electrolito.
Un electrolito es cualquier sustancia, normalmente líquida, que contiene iones libres, que se comportan como un medio conductor eléctrico.
Normalmente un electrolito es una disolución, en la que el disolvente suele ser agua y el soluto otra sustancia. El ejemplo más conocido es el agua del mar (el cloruro sódico es un agente corrosivo), que actúa como electrolito.
Los procesos de corrosión son procesos electroquímicos, ya que en la superficie
del metal se generan “micropilas galvánicas” en las que la humedad actúa como
electrolito. El metal actúa como ánodo (polo positivo) y, por lo tanto, se disuelve. Así,
el electrolito actúa como medio conductor a través del cual viajan las cargas que
abandonan los electrones del ánodo que se corroe, el metal.
Existe un tipo de corrosión de tipo electroquímico que aparece cuando se juntan
metales diferentes o son conectados eléctricamente. Al producirse el contacto, el
metal más electronegativo desempeña el papel de ánodo y, por tanto, sufre la
corrosión.
Protección contra la oxidación y la corrosiónImpedir la corrosión implica impedir reacciones electroquímicas. Es decir,
eliminar la posible presencia de un electrolito que actúe como medio conductor para
facilitar una reacción de transferencia de electrones desde un metal anódico. Así, las
soluciones podrían ser:
a) Protección por recubrimiento: Es decir, crear una capa o barrera que aisle el metal
del entorno. Dentro de este tipo de protección podemos hallar
a) Recubrimientos no metálicos: siendo los más comunes...
· Pinturas y barnices: Es económico y exige que la superficie esté limpia de óxidos y grasas
· Plásticos: Son muy resistentes a la oxidación y son flexibles, pero apenas resisten el calor. El más empleado es el PVC.
· Esmaltes y cerámicos: Tiene la ventaja de resistir las altas
temperaturas y el desgastes.
b) Recubrimientos metálicos:
· Inmersión : Se recubre el metal a proteger en un baño de metal fundido. El metal al solidificar forma una fina capa protectora. Los metales más empleados son...
a) Estaño (la técnica se llama estañado): latas de conserva
b) Aluminio: (la técnica se llama aluminización): Es económico y con
calidad.
c) Plomo: (la técnica se llama plombeado): Para recubrir cables y
tuberías.
d) Cinc: (la técnica se llama galvanizado): Para vigas, vallas, tornillos,...
y otros objetos de acero.
· Electrodeposición : En este caso se
hace pasar corriente eléctrica entre
dos metales diferentes que están
inmersos en un líquido conductor que
hace de electrolito. Uno de los
metales será aquel que hará de
ánodo, el cual se oxidará y
sacrificará. El otro metal, el que se
desea proteger, hará de cátodo y
ambos estarán inmersos en el
electrolito que estarán en una cuba. Cuando pasa la corriente
eléctrica, sobre el metal catódico se crea una fina capa protectora
hecha del material procedente del metal anódico, pues la pila obliga a
ceder electrones al ánodo que alcanzarán al cátodo. Cuando el metal
que hace de cátodo y se desea proteger es acero y el otro que va a
protegerlo (que hace de ánodo) es cinc, el proceso se llama
galvanizado.
b) Protección por capa química: Se provoca la reacción de las piezas con un agente
químico que forme compuestos en su superficie que darán lugar a una capa protectora.
Por ejemplo:
▪ Cromatizado: Se aplica una solucion de ácido crómico sobre el metal a
proteger. Se forma una capa de óxido de cromo que impide su corrosión.
▪ Fosfatación: Se aplica una solución de ácido fosfórico y fosfatos sobre el
metal. Se forma una capa de fosfatos metálicos que la protegen del
entorno.
c) Protección catódica: Se fuerza al metal a comportarse como un cátodo, suministrándole
electrones. Se emplea otro metal que estará en contacto con el metal que se desea proteger, llamado “ánodo de sacrificio”, el cual se corroe y acaba destruyéndose aportando electrones al metal. En definitiva, el metal “ánodo de sacrificio” se pone en contacto con el metal a proteger el cual recibe electrones del primero. Se necesita la
presencia de un electrolito. Se emplea mucho en tuberías enterradas.
d) Inhibidores: Se trata de añadir productos químicos al electrolito para disminuir la
velocidad de la corrosión. Ejemplo: Sales de cromo. Se echan a los radiadores de los
coches.
· Inmersión : Se recubre el metal a proteger en un baño de metal fundido. El metal al solidificar forma una fina capa protectora. Los metales más empleados son...
a) Estaño (la técnica se llama estañado): latas de conserva
b) Aluminio: (la técnica se llama aluminización): Es económico y con
calidad.
c) Plomo: (la técnica se llama plombeado): Para recubrir cables y
tuberías.
d) Cinc: (la técnica se llama galvanizado): Para vigas, vallas, tornillos,...
y otros objetos de acero.
· Electrodeposición : En este caso se
hace pasar corriente eléctrica entre
dos metales diferentes que están
inmersos en un líquido conductor que
hace de electrolito. Uno de los
metales será aquel que hará de
ánodo, el cual se oxidará y
sacrificará. El otro metal, el que se
desea proteger, hará de cátodo y
ambos estarán inmersos en el
electrolito que estarán en una cuba. Cuando pasa la corriente
eléctrica, sobre el metal catódico se crea una fina capa protectora
hecha del material procedente del metal anódico, pues la pila obliga a
ceder electrones al ánodo que alcanzarán al cátodo. Cuando el metal
que hace de cátodo y se desea proteger es acero y el otro que va a
protegerlo (que hace de ánodo) es cinc, el proceso se llama
galvanizado.
b) Protección por capa química: Se provoca la reacción de las piezas con un agente
químico que forme compuestos en su superficie que darán lugar a una capa protectora.
Por ejemplo:
▪ Cromatizado: Se aplica una solucion de ácido crómico sobre el metal a
proteger. Se forma una capa de óxido de cromo que impide su corrosión.
▪ Fosfatación: Se aplica una solución de ácido fosfórico y fosfatos sobre el
metal. Se forma una capa de fosfatos metálicos que la protegen del
entorno.
c) Protección catódica: Se fuerza al metal a comportarse como un cátodo, suministrándole
electrones. Se emplea otro metal que estará en contacto con el metal que se desea proteger, llamado “ánodo de sacrificio”, el cual se corroe y acaba destruyéndose aportando electrones al metal. En definitiva, el metal “ánodo de sacrificio” se pone en contacto con el metal a proteger el cual recibe electrones del primero. Se necesita la
presencia de un electrolito. Se emplea mucho en tuberías enterradas.
d) Inhibidores: Se trata de añadir productos químicos al electrolito para disminuir la
velocidad de la corrosión. Ejemplo: Sales de cromo. Se echan a los radiadores de los
coches.















No hay comentarios:
Publicar un comentario